EL SISTEMA NERVIOSO.
A lo largo de nuestra vida debemos identificar los estímulos externos e internos que recibimos constantemente para responder a ellos , los estímulos internos como el cambio en la presión sanguínea , la sensación de hambre y estímulos externos como la temperatura, la luz, el movimiento
l sistema nervioso es el conjunto de tejidos y órganos encargados de interpretar la información recibida , coordinar y dirigir todas las funciones del organismo y para ello cuenta con células especializadas o CELULAS NERVIOSAS denominadas células gliales y neuronas .
las células gliales dan soporte y, defensa y nutrientes a las neuronas las cuales son especializadas en en la recepción, la conducción y la transmisión de información.
LAS NEURONAS:
Las neuronas constituyen las unidades fisiológicas y anatómicas del sistema nervioso. Se encargan de recibir impulsos, elaborarlos y transmitirlos de nuevo.La neurona tiene una prolongación del cuerpo celular. Constan de:
Dentritas: Su función es recoger estímulos que llegan a la neurona y también transportar hasta esta los nutrientes que requiere para su mantenimiento.
Axón: Se origina en una estructura especial del cuerpo celular de la neurona. Es de forma cilíndrica y su longitud varia entre unos milímetros y varios centímetros. Su función es transmitir los impulsos procedentes de la neurona a otra neurona o a los órganos efectores. Liberan unas sustancias químicas llamadas Neurotransmisores. Esta recubierto de manera discontinua por una sustancia protectora de color blanco llamada Mielina.
Cuerpo neuronal: Es siempre irregular, puede adoptar formas muy diversas. En el citoplasma posee una sustancia que desempeña un papel fundamental en la transmisión de impulsos. El núcleo es esférico y de gran tamaño.
Se distinguen básicamente atendiendo a su función tres tipos de neuronas:
Neuronas sensoriales: Constituyen el sistema nervioso central, conducen el impulso desde los receptores hasta los otros nervios.
Neuronas asociadas: Que forman los elementos intermedios en la transmisión de impulsos, participando en las funciones de coordinación de todo el sistema.
Neuronas motoras: Que suelen estar conectadas a las neuronas asociadas y se encargan de transmitir los impulsos a los órganos efectores.
IMPULSO NERVIOSO:
El impulso nervioso es el conjunto de de reacciones eléctricas y químicas que permiten la transmisión de información entre neuronas gracias a los mecanismos de los canales iónicos y la bomba sodio potasio.
Los canales iónicos son poros ubicados en la membrana celular de las neuronas y permiten el paso de iones o partículas atómicas cargadas electricamente tanto positivas como negativas especialmente sodio y potasio.
La bomba Sodio Potasio es un mecanismo que permite el flujo de iones sodio y potasio en forma permanente entre la neurona y el medio extracelular .
Encéfalo: Es la porción del sistema nervioso encerrada en el interior de la caja craneana. Consta de:
Cerebro: Esta dividido en dos porciones (hemisferios cerebrales). Los hemisferios constan de una zona exterior con gran cantidad de surcos y circunvoluciones que es la corteza. La Corteza cerebral esta formado por una sustancia blanca y gris en ellas se localizan los centros del pensamiento, el habla, la inteligencia, creatividad, voluntad, juicio, tacto, gusto, olfato, vista y oído.
Cerebelo: Se encuentra en la zona inferior de la parte posterior de la masa encefálica .Tiene dos porciones laterales (hemisferios cerebelosos). Es el centro coordinador del movimiento y del equilibrio.
Bulbo raquídeo: Es una prolongación de la medula.tiene como funciones el control de muchas actividades vitales del organismo: el corazón, la respiración, el sueño y el vomito. Situado bajo el cerebro, en su parte central, conecta el encéfalo con la medula espinal.
Medula Espinal: Es la porción del tejido nervioso situada en el interior del canal de la columna vertebral. Formada por una sustancia gris. su función es transmitir los impulsos motores y los censores de la periferia del cuerpo. En ella se elabora respuestas rápidas e involuntarias (actos reflejos)
El Sistema nervioso periférico esta formado por neuronas sensitivas y motoras. Su función es transmitir información en forma de impulsos nerviosos, entre el sistema nervioso central y los demás órganos del cuerpo. Consta de nervios y ganglios: Los nervios son fibras nerviosas rodeadas de una cubierta que las protege y aísla, formados por la asociación de axones. Los ganglios son grupos de neuronas y fibras nerviosas. Se presentan como engrosamiento situados a lo largo de los nervios cerebrales y espinales, actúan como forma de conexión.
Sistema somático-sensorial: Su función es transmitir los impulsos hasta el sistema nervioso central. Sus acciones están dirigidas por la voluntad.
Sistema nervioso autónomo: Esta formado por una serie de neuronas sensoriales y motoras que se conectan a los órganos internos. Las acciones son automáticas aunque interviene la voluntad.
Sistema nervioso simpático: Las acciones producidas por el sistema simpático son de tipo general: dilata la pupila, acelera el ritmo cardiaco, dilata los bronquios e inhibe la salivación, el peristaltismo y la contracción de la vejiga.
Sistema nervioso parasimpático: Las acciones del sistema parasimpático se complementan con las del simpático: contrae la pupila, atenúa el ritmo cardiaco, contrae los bronquios y estimula la salivación el peristaltismo y la contracción de la vejiga.
SISTEMA ENDOCRINO:
Esta compuesto por un conjunto de glándulas repartidas por todo el cuerpo que segregan una serie de sustancias. Fundamentalmente su función es el metabolismo en el crecimiento, en la reproducción y el desarrollo de los tejidos. Se denominan glándulas endocrinas o glándulas de secreción interna.
HORMONAS Y GLANDULAS:
Actúan únicamente sobre sus células blanco, activando o inhibiendo el funcionamiento de los órganos efectores a los que pertenecen. Además actúan en cantidades muy pequeñas por lo que su concentración en el organismo es siempre muy baja.
1)____ 6)____ 11)____ 16)____
2)____ 7)____ 12)____ 17)____
3)____ 8)____ 13)____ 18)____
4)____ 9)____ 14)____ 19)____
5)____ 10)____ 15)____ 20)____
Un estímulo es aquello que genera reacción en un ser vivo.Hace que este mismo tome información del ambiente y genere una respuesta.
Una respuesta es lo que hace el individuo en reacción al estimulo.
Los receptores son los que reciben el estímulo y pueden ser una célula, un órgano o un sistema.
DISTINTOS TIPOS DE RECEPTORES:
FOTORRECEPTORES: para poder detectar el estimulo de la energía lumínica.
TERMORRECEPTORES: para percibir la energía térmica.
QUIMIORRECEPTORES: para detectar la energía que se libera en las reacciones químicas con sustancias provenientes del agua, los nutrientes o sustancias tóxicas producidas por el mismo individuo, por otros de su misma especie o por individuos de distintas especies.
MECANORRECEPTORES: para detectar la energía mecánica que produce el contacto con otros individuos u objetos.
Tropismo y Nastias:
tropismo: son movimientos de curvatura de una parte de la planta respondiendo a la dirección de un estimulo, ya sea a favor o en contra.,
nastia: son movimientos de partes de la planta que se realizan un modo predeterminado.
Tipos de tropismos:
fototropismo: es el movimiento de una planta hacia donde proviene un estimulo lumínico.
heliotropismo: en este caso las hojas y/o flores rastrean la dirección en que les llegan los rayos del sol, y se van moviendo en el mismo sentido .
tigmotropismo: en el tigmotropismo positivo se observa en plantas trepadoras o epífitas,y se dirige hacia donde se encuentra el estimulo.El negativo se observa en las raíces. Si el extremo de una raíz durante su crecimiento se topa con un objeto que lo obstaculiza, responde alejándose del estímulo. En síntesis es la respuesta al tacto, cuando la planta crece agarrada a una superficie solida.
gravitropismo: es cuando en el crecimiento de una planta esta responde al estimulo de la gravedad.
Las raíces tienen gravitropismo positivo ya que crecen hacia abajo respondiendo al estímulo de la gravedad, en cambio el tallo crece con gravitropismo negativo por que crece hacia arriba y se endereza, en contra de la gravedad.
hidrotropismo: como una forma de asegurarse el líquido vital, las raices de algunas plantas responden a gradientes o variaciones de humedad. Si se las expone a ambientes con distintos porcentajes de humedad relativa, cambian la dirección del crecimiento del extremo de la raíz, la respuesta hidrotropica se pierde, sin que se vea afectada la velocidad de crecimiento de la raiz.
escototropismo: la oscuridad es también un estimulo. Por ejemplo las plantas bajas que crecen en un bosque muy frondoso, al no llegar la luz hasta el piso, lo que ellas hacen es treparse a un árbol hasta la copa para poder lograr altura y así recibir luz solar. A esto se lo denomina escototropismo. Un ejemplo es la enredadera Monstera gigantea.
|
MATERIALES
caja pequeña de cartón , semillas secas de frijol o de arvja, vaso plástico, algodón, agua
PROCEDIMIENTO.
En un vaso con agua y algodón en la parte superior coloque dos o tres semillas secas de frijol o de arveja coloque dentro de la caja de cartón, abra un hueco de 3 x 3 cm en uno de los costados a pocos cm de la planta , selle la caja y colóquela en un lugar bien iluminado, al cabo de 20 días observe y escriba los resultados, abra la caja , tome la foto y envié
6) Escriba la razón por la cual las enfermedades genéticas humanas ligadas al sexo son mucho más comunes en hombres que en mujeres.
7) Nombre las características dela hemofilia y el daltonismo y la forma como se transmiten estas enfermedades a través de la descendencia..
8) Sabiendo que algunos caracteres genéticos como la enfermedad de la hemofilia , están determinados por un gen recesivo ligado al cromosoma X ,¿ Como podran ser los descendientes de un hombre normal (XHY) y una mujer portadora (XHXh) ?
9) Dibuje y Observe el siguiente cariotipo ( conjunto de cromosomas ) y deduzca a que sexo pertenece.
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
| |
A
|
X
|
X
|
X
|
X
|
X
|
X
|
X
| |||||||||||||
B
|
X
|
X
| ||||||||||||||||||
C
|
X
|
X
|
X
|
X
|
X
| |||||||||||||||
D
|
X
|
X
|
X
|
X
|
A) 2,5M B) 2,0M C) 1,5M D) 1,0M
A) 1,3 B) 13,3 C) 2,3 D) 4
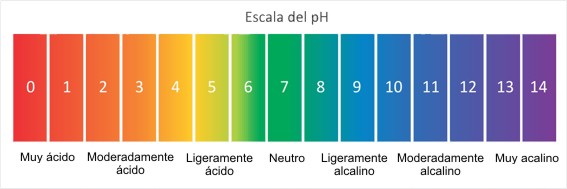
A) –Log[14-X] B) –Log 2X] C) –Log [X] D) –Log [1/X]
La entrevista debe iniciar con un saludo al publico presente y al entrevistado.
6) Que cuidados cree se que deben tener hoy día con el uso de su experimento?.

ELECTRÓLISIS
https://invdes.com.mx/los-investigadores/chon-los-elementos-de-la-quimica-organica-primera-parte/
(A cargo de .............)
METODOLOGIA.
VALIDO PARA LOS CINCO PRIMEROS ESTUDIANTES QUE ENVÍEN LA INSCRIPCIÓN A LA PARTICIPACIÓN , SE EVALÚA COMO TRABAJO DE LA SEMANA Y POR LO TANTO NO DEBERÁN ENVIAR ACTIVIDAD,
DÍA MARTES 01 DE SEPTIEMBRE. HORA 1,25 P.M
2) Cuales son las principales formas de carbono en la naturaleza.
3) Como se forman los diamantes y cuales son sus aplicaciones?
4) Nombre 5 compuestos orgánicos y su importancia.
5) Como se obtiene el caucho natural y cuales son sus aplicaciones?
6) Que son los combustibles fósiles?
ACTIVIDAD NUMERO 3: EL ATOMO DE CARBONO
https://www.caracteristicas.co/atomo-de-carbono/
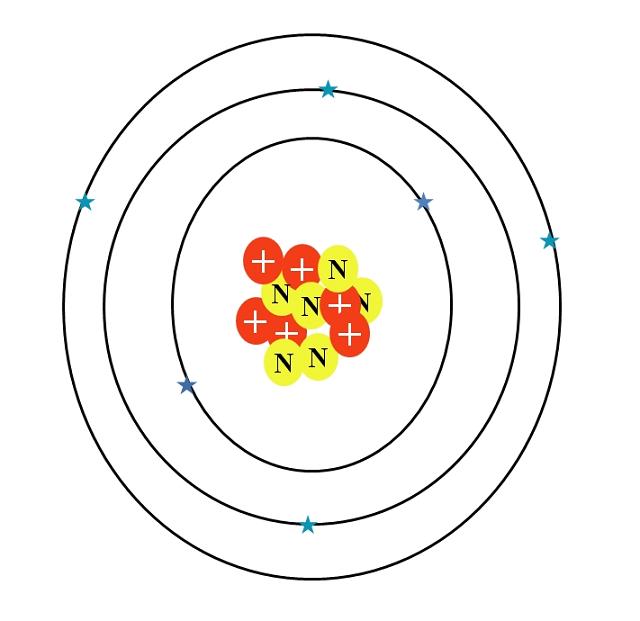
El átomo de carbono se simboliza con la letra C. Su número atómico Z es 6, por lo tanto, tiene seis protones . Además, posee seis neutrones y seis electrones
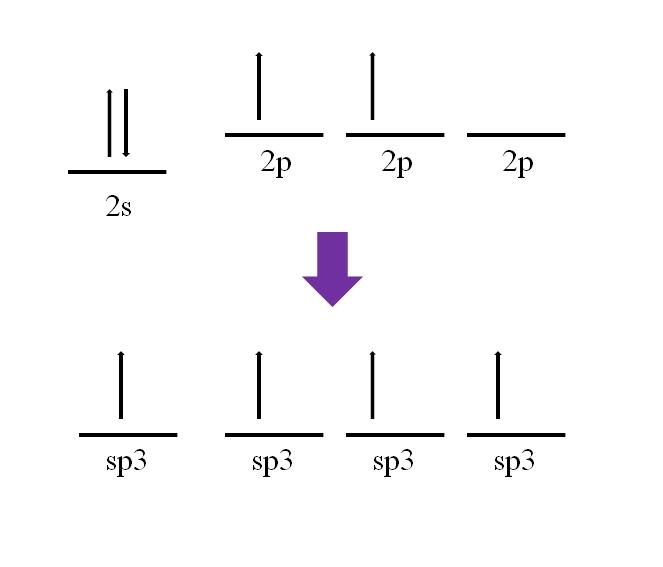
Su configuración electrónica es: 1s22s22p2
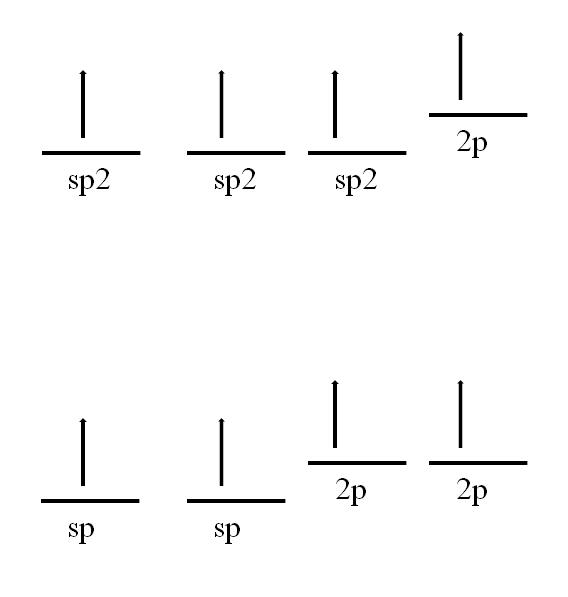
sp2 y sp
Dentro de una molécula los átomos de carbono puede clasificarse de como primarios, secundarios, terciarios y cuaternarios .
Un carbono primario es aquel que está enlazado solamente a otro carbono. Por ejemplo, la molécula de etano, CH3–CH3 consiste de dos carbonos primarios enlazados. Este señala el final o comienzo de una cadena carbonada.
Un carbono secundario es aquel que se encuentra enlazado a dos carbonos. Así, para la molécula de propano, CH3–CH2–CH3, el átomo de carbono del medio es secundario
Los carbonos cuaternarios se encuentran enlazados a otros cuatro átomos de carbono. ejemplo C(CH3)4 posee un átomo de carbono cuaternario.
Erika Bocanegra entrevista a Friedrich August Kekulé von Stradonitz, Representado por Gabriel Ojeda.
Donde nació? Que estudios realizo? , Como llego a crear la estructura molecular del Benceno? ,En que consistió el sueño que le ayudo a crear el modelo de la molécula de Benceno.?
Saira Navarro habla del Petróleo
Ivan Giraldo y Yeisson Jimenez hablan del Carbono.
Se denominan Series Homologas al conjunto de compuestos que tienen el mismo grupo funcional , pero difieren en el número de átomos de carbono de sus moléculas, es decir en el número de unidades CH2 .Ejemplo , La siguiente es una serie homologa de hidrocarburos
CH3- CH2-CH2-CH2-CH2-CH2-CH2-CH3
CLASIFICACION SEGÚN LA ESTRUCTURA.
Dentro de algunos grupos funcionales, los compuestos orgánicos se subdividen de acuerdo con la forma o la estructura que se presenten como: compuestos acíclicos o de cadena abierta o alifáticos y compuestos cíclicos o de cadena cerrada .
Los compuestos aciclicos o de cadena abierta o alifáticos a su vez pueden ser de cadena línea o de cadena ramificada:

Compuestos isociclicos en los que los ciclos están formados únicamente por uniones de carbono . dentro de este grupo se hallan los compuestos aromáticos y los compuestos alicíclicos .
Los compuestos aromáticos se caracterizan porque presentan una molécula de benceno como base principal
Los compuestos heterocíclicos presentan al menos un átomo diferente al carbono en su estructura cíclica . ejemplo la piridina
NOMENCLATURA DE LOS COMPUESTOS ORGANICOS.
La nomenclatura de los compuestos orgánicos se basa en el numero de carbonos que formen parte de la estructura y el tipo y posición ocupada por los grupos funcionales presentes por lo cual es importante conocer que un sustituyente es un átomo o grupo de átomos que se encuentran unidos a una cadena hidrocarbonada , reemplazando un átomo de hidrogeno correspondiente al alcano por ejemplo si en la molécula de Metano (CH4) uno de los hidrógenos es reemplazado por un átomo de Cloro , este será un sustituyente en la molécula original.
Los Hidrocarburos son compuestos orgánicos cuyas moléculas están constituidas por cadenas de carbonos sobre las cuales se encuentran unidos átomos de Hidrogeno y forman principalmente la mayoría de combustibles derivados del petróleo
Los hidrocarburos se clasifican en Alcanos ( enlaces simples ) , Alquenos ( al menos un enlace doble en la molécula ) , Alquinos ( al menos un enlace triple en la molécula ).
Para nombrarlos se tiene en cuenta el número de carbonos que están determinados por un prefijo asi : Met ( 1 C ), Et ( 2 C) , Prop ( 3 C ), But (4 C ) , Pent ( 5 C ), Hex ( 6 C ), Hept ( 7 C ), Oct ( 9 C ), Non ( 9 C ), Dec ( 10 C ) , Undec ( 11 C ) , Dodec ( 12 C ), Tridec (13 C ), Tetradec ( 14 C ), Eicos ( 20 C ), Eneicos ( 21 C ) Tetracont ( 40 C ) y el sufijo o terminación que indica la función que se desea nombrar , ano , eno, ino .
En el caso de los Alquenos y Alquinos , los prefijos se conservan , mientras que en lugar de la terminación -ano se añade eno o ino según el caso . Si se trata de un grupo alquilo , se utiliza la terminación ilo o il .
PROCEDIMIENTO PARA NOMBRAR LOS HIDROCARBUROS
1) Se escoge la cadena de carbonos mas larga. Esta constituye el alcano principal con respecto al cual se nombra la estructura , considerando las cadenas menores como sustituyentes
2) Se numeran los átomos de Carbono constitutivos de la principal , comenzando por el extremo desde el cual los carbonos que poseen el grupo funcional o los sustituyentes reciban los números mas bajos posibles.
3) Se indican los nombres del grupo o los sustituyentes de la cadena principal, precedidos del número que corresponde al átomo de carbono al que están unidos. Si existen dos grupos sobre el mismo carbono, se repite el número delante del segundo grupo. Si un mismo sustituyente aparece más de una vez en la cadena, los números de las posiciones que ocupan se enumeran , separados entre si por comas, y se usan los prefijos di, tri, tetra, penta, hexa etc. Para indicar el numero de veces que aparece dicho grupo.
CH3
Ι 67
CH3 - CH - CH - CH2 - CH2 - CH - CH2 - CH3
1 2 3 / 4 5 Ι
CH3 CH2-CH3
En muchos hidrocarburos, los átomos de carbono no sólo se unen para formar una cadena lineal, sino que presentan ramificaciones; esto es, cadenas de átomos de carbono que se unen a la principal eliminando un hidrógeno en ella. En seguida se muestran dos ejemplos: |
O bien: |
Cuando los hidrocarburos están formados por varias ramificaciones, se denominan hidrocarburos arborescentes o ramificados. Algunas propiedades de los hidrocarburos ramificados difieren de las que presentan los hidrocarburos lineales. Los hidrocarburos lineales se utilizan mucho como disolventes industriales con el propósito de extraer aceites de semillas como la soya, el algodón y el maíz. Los hidrocarburos ramificados son componentes importantes de las gasolinas. Los hidrocarburos también pueden formar ciclos cuando el último carbono de una cadena abierta se une con el primero. Los hidrocarburos cíclicos pueden formarse con tres o más átomos de carbono. Por ejemplo, el octano se enlaza para formar un ciclo (Fig. 1). Cuando el octano forma un ciclo, su nombre cambia a ciclooctano. |
Fig. 1 Octano y ciclooctano. |
Un ejemplo importante de los hidrocarburos cíclicos es el benceno, cuya fórmula condensada o molecular es C6H6. Este compuesto es un disolvente industrial usado para la producción de insecticidas, explosivos y medicamentos. |
Fig. 2 Benceno. |
| Los isómeros |
Algunos hidrocarburos presentan la misma fórmula condensada, pero diferente fórmula desarrollada; por ejemplo, el alcano ramificado: |
Aunque este compuesto posee la misma fórmula condensada que el butano: C4H10, se trata de compuestos diferentes; uno es un hidrocarburo lineal que se condensa a 0.5 °C y se conoce como butano normal, y el otro es un hidrocarburo ramificado, que se condensa a –12 °C y se llama isobutano. A compuestos como éstos, que poseen la misma fórmula condensada pero diferente fórmula desarrollada, se les llama isómeros. Los isómeros son compuestos distintos uno de otro, con propiedades químicas y físicas también diferentes. El 1-penteno y el 2-penteno son isómeros. En este caso, se distinguen por la posición del doble enlace: |
La mayoría de los hidrocarburos tienen isómeros, que se presentan en los siguientes casos:
En los alcanos, por ejemplo, hay tres posibles pentanos, cinco hexanos, nueve heptanos... y hasta 75 decanos diferentes. |
Numero de CARBONOS (n) | PREFIJO | Nombre del ALCANO | FORMULA GENERAL CnH2n+2 | Formula desarrollada | Formula Semidesarrollada |
1 | Met | Metano | CH4 | CH4 | CH4 |
2 | Et | Etano | C2H6 | CH3CH3 | CH3CH3 |
3 | Prop | Propano | C3H8 | CH3CH2CH3 | CH3CH2CH3 |
4 | But | Butano | C4H10 | CH3CH2CH2CH3 | CH3(CH2)2CH3 |
5 | Pent | Pentano | |||
6 | Hex | ||||
7 | Hept | ||||
8 | Oct | ||||
9 | Non | ||||
10 | Dec | ||||
11 | Undec | ||||
12 | Dodec | ||||
13 | Tridec | ||||
20 | Eicos | ||||
40 | Tetracont |
3) Escriba formulas estructurales para cada uno de los siguientes compuestos.
a) 3, 4-dimetil octano
b) 3, 4, 5-trimetil octano
c) 3-etil heptano
d) 3,3 –dietil decano
e) 3-metil-3-etilundecano
4) Escriba la diferencia entre los siguientes conceptos.
a) Compuesto alicíclico y compuesto cíclico, b) compuestos aromáticos y compuestos heterociclico c) alcanos, alquenos y alquinos. d) Sustituyente y radical e) grupo funcional y serie homologa.
5) Escriba los prefijos utilizados para nombrar los primeros 10 compuestos químicos de cualquier función química orgánica.
6) Escriba la Función Química a la que pertenecen cada uno de los siguientes compuestos.
LA COMBUSTION.
Materiales.
Trozo pequeño de vela de parafina, fósforos, vaso de vidrio, plato sopero , agua, cinta adhesiva. esfero.
PROCEDIMIENTO
1) Escriba 10 observaciones organolépticas de la vela (utilizando únicamente los sentidos).
2) Encienda la vela, y escriba 5 observaciones organolépticas de la llama.
3) Pegue o adhiera la vela en el fondo del plato utilizando la misma parafina derretida de la vela.
4) Una vez adherida la vela al fondo del plato agregue agua hasta la mitad de la vela.
5) Coloque el vaso en forma invertida sobre la vela encendida hasta dejarlo sobre el plato.
6) Observe y responda las siguientes preguntas.
a) Que le ocurrió a la llama de la vela ¿Porque?
b) ¿Cómo es el nivel del agua dentro y fuera del vaso? Porque? Escriba una Hipótesis o suposición o explicación.
c) ¿Qué observa en las paredes internas del vaso? Porque?
d) Que sustancias químicas se requieren en una reacción de combustión?
e) Que sustancias se producen en una combustión?